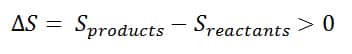热力学的第一律:这是能源保护规律。宇宙中的能量总量是恒定的。无法创造能量,也不会被摧毁。
我们已经看到,能量可以从系统转移到周围环境,反之亦然。在这些过程中,没有能量创造也不破坏
焓变为:能量用于破坏键,然后在形成新的键时释放能量。这些能量之间的差异是焓的变化。
债券能源:打破债券所需的能量。高能量与非常稳定的粘合剂相关。
| 债券类型 | 债券能量 (kj / mol) |
| H - H. | 436. |
| C - H. | 413. |
| N - H. | 391. |
| C - C. | 346. |
| C = C. | 615. |
| C - N. | 305. |
| 哦 | 436. |
| C - O. | 358. |
| C = O. | 749. |
| 不 | 222. |
自发反应:天然存在的反应,并且不必被迫发生(通过使用热或电)。
非自发反应:除非能量施加能量,否则不会发生的反应。
放热反应通常是自发的。例如:燃烧反应。
吸热反应通常是非自发的,例如:电解和分解
然而,许多吸热过程是自发的
例如:将硝酸铵溶解在水中吸收热量。
为什么产生不太稳定的产品的反应自发发生?
熵:疾病或随机性的衡量标准。它可以应用于一个系统,周边环境或宇宙。
例如:一块卡片甲板布置着与王国到国王的所有诉讼都是非常有序的。这将具有低熵。在空中抛出的一张卡片将随机降落在地板上,所有的卡片都混淆了。这将具有高熵。
热力学第二律:宇宙的熵总是增加。
- 这意味着如果它们增加熵,所有过程往往是自发的
- 仅当它们伴随宇宙熵的等于或更大增加时,才能减少熵的过程。
例如:建筑物的人必须分解葡萄糖和脂肪的能量。
- 自发过程倾向于增加熵(意味着更多紊乱)
反应熵:Δs> 0如果;
- 有更多的产品制成的产品比使用的反应物摩尔
- 复杂的分子被破坏为简单的亚基
- 物质将状态从固体变为液体/气体或从液体到气体
吉布斯自由能
Gibbs FreeCergy(g):可以做工作的能量数量。这可以通过组合系统的焓和熵来找到。
自发性:过程的自发性取决于GIBBS自由能的变化是否为负(ΔG<0)。
Δg<0反应是自发的
Δg> 0反应不是自发的
引用本文为:威廉安德森(SchoolWorkeHelper编辑团队),“自发性和热力学,”学校努力,2019年,//www.chadjarvis.com/spontaneity-和 - 热学动力学/。
帮助我们用旧的散文修复他的笑容,需要几秒钟!

- 我们正在寻找你aced的上一篇文章,实验室和作业!
- 我们将在我们的网站上审核并发布它们。-AD收入用于支持发展中国家的儿童。
- 通过操作微笑和微笑火车,帮助支付腭裂修复手术。